原子的质量集中在包含质子和中子的原子核上。质子是带正电荷的粒子,而中子是中性粒子——两者的质量差不多。原子核中的质子数是元素的原子序数 Z。
与原子核的大小相比,电子被假定在非常远的距离上围绕原子核运行。轨道上的电子和原子核中的质子一样多。
玻尔原子模型
具有固定半径的离散量子化轨道中的电子轨道原子核,因此我们可以将电子视为包含在给定半径的球壳内的电荷。电子可以通过失去 (发射) 或获得 (吸收) 能量从一个轨道跳到另一个轨道。
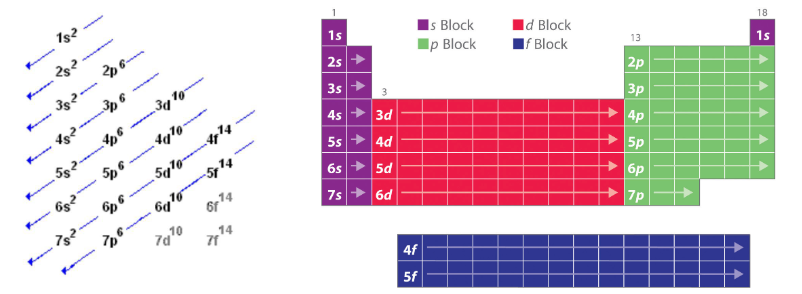
电子不会随机地占据原子核周围的整个区域。相反,它们占据了定义良好的球形区域。它们分布在不同的壳和壳内的子壳中,遵守一定的规则。定义电子位置的壳层和亚壳层用两组整数标记,
玻尔原子模型的显著特征
- 电子以稳定的轨道围绕原子核旋转,不释放辐射能。每个轨道都有一个确定的能量,被称为能量壳层或能级。
- 轨道或能级用 K、L、M、N 壳层表示。当电子处于最低能级时,我们说它处于基态。
- 电子从一个轨道或能级跳到另一个轨道或能级时,会发射或吸收能量。当它从高能级跃迁到低能级时,它发出能量;当它从低能级跃迁到高能级时,它吸收能量。
壳层命名规则
定义电子位置的壳层和亚壳层用两组整数标记,
- 整数
= 1, 2, 3,…,和 = 0, 1, 2,…, n−1,并且满足 。对于每个 的选择,有 个 的值,因此高阶壳层包含更多的子壳层。 = 1, 2, 3, 4,…所对应的壳层用大写字母 K, L, M, N…,子壳层表示为ℓ= 0, 1, 2, 3,…标记为 s, p, d, f … .
电子填充规则
在
- 用电子填充亚层时有一个明确的规则,我们不能简单地把所有电子放在一个亚层中。
- 给定亚层的电子数为:
- 每层电子的最大数量是
- 给定亚层的电子数为:
每个壳层内都有亚壳层,标记为 s, p, d, f。注意一个能级的亚壳层数=该能级的数量。
亚壳层
在每个亚层中,都有轨道。这是电子驻留的最终位置。每个亚层有一定数量的轨道。
| 亚层 | 轨道数量 |
|---|---|
| s | 1 |
| p | 3 |
| d | 5 |
| l | 7 |
一个轨道最多能占 2 个电子。
电子排布
原子间相互作用
占据外层亚壳层的电子离原子核最远,在原子相互作用中起着最重要的作用,因为这些电子首先与邻近原子上的外层电子相互作用。最外层的电子称为价电子,它们决定了原子的价电子。
- 【化学】化合能力: 一种元素的化合能力,尤指以它能取代或结合的氢原子的数量来衡量
- 当一个亚电子层充满电子时,它就不能再接受更多的电子,这样就得到了一个稳定的结构。元素周期表右边的惰性元素就是这样,它们的亚层都已完全填满,很少参与化学反应。
电子跃迁
电子可以通过从一个允许的轨道跳到另一个允许的轨道而获得和失去能量,吸收或发射电磁辐射。辐射频率
普朗克关系式
指向原始笔记的链接
电子符号

